高中化學必修二【第二章 化學反應與能量】知識點歸納!
化學反應是伴隨著能量的變化的,這就是化學能!本文,伊頓教育一對一輔導小編將為同學們分享高中化學必修二第二章 化學反應與能量知識點歸納,希望能夠幫助到各位同學!!!小編也建議大家在學習的過程中學會自己總結和歸納知識點,這能夠幫助大家更好的學習!

第二章 化學反應與能量
第一節 化學能與熱能
1、在的化學反應中總伴有能量的變化。
原因:當物質發生化學反應時,斷開反應物中的化學鍵要吸收能量,而形成生成物中的化學鍵要放出能量。化學鍵的斷裂和形成是化學反應中能量變化的主要原因。一個確定的化學反應在發生過程中是吸收能量還是放出能量,決定于反應物的總能量與生成物的總能量的相對大小。E反應物總能量>E生成物總能量,為放熱反應。E反應物總能量
2、常見的放熱反應和吸熱反應
常見的放熱反應:①的燃燒與緩慢氧化。②酸堿中和反應。③金屬與酸反應制取氫氣。
④大多數化合反應(特殊:C+CO2 2CO是吸熱反應)。
常見的吸熱反應:①以C、H2、CO為還原劑的氧化還原反應如:C(s)+H2O(g) CO(g)+H2(g)。
②銨鹽和堿的反應如Ba(OH)2·8H2O+NH4Cl=BaCl2+2NH3↑+10H2O
③大多數分解反應如KClO3、KMnO4、CaCO3的分解等。
3、能源的分類:
|
形成條件 |
利用歷史 |
性質 |
|
|
一次能源
|
常規能源 |
可再生資源 |
水能、風能、生物質能 |
|
不可再生資源 |
煤、石油、天然氣等化石能源 |
||
|
新能源 |
可再生資源 |
太陽能、風能、地熱能、潮汐能、氫能、沼氣 |
|
|
不可再生資源 |
核能 |
||
|
二次能源 |
(一次能源經過加工、轉化得到的能源稱為二次能源) 電能(水電、火電、核電)、蒸汽、工業余熱、酒精、汽油、焦炭等 |
||
[思考]一般說來,大多數化合反應是放熱反應,大多數分解反應是吸熱反應,放熱反應都不需要加熱,吸熱反應都需要加熱,這種說法對嗎?試舉例說明。
點拔:這種說法不對。如C+O2=CO2的反應是放熱反應,但需要加熱,只是反應開始后不再需要加熱,反應放出的熱量可以使反應繼續下去。Ba(OH)2·8H2O與NH4Cl的反應是吸熱反應,但反應并不需要加熱。
第二節 化學能與電能
1、化學能轉化為電能的方式:
|
電能 (電力) |
火電(火力發電) |
化學能→熱能→機械能→電能 |
缺點:環境污染、低效 |
|
原電池 |
將化學能直接轉化為電能 |
優點:清潔、 |
2、原電池原理
(1)概念:把化學能直接轉化為電能的裝置叫做原電池。
(2)原電池的工作原理:通過氧化還原反應(有電子的轉移)把化學能轉變為電能。
(3)構成原電池的條件:(1)電極為導體且活潑性不同;(2)兩個電極接觸(導線連接或直接接觸);(3)兩個相互連接的電極插入電解質溶液構成閉合回路。
(4)電極名稱及發生的反應:
負極:較活潑的金屬作負極,負極發生氧化反應,
電極反應式:較活潑金屬-ne-=金屬陽離子
負極現象:負極溶解,負極質量減少。
正極:較不活潑的金屬或石墨作正極,正極發生還原反應,
電極反應式:溶液中陽離子+ne-=單質
正極的現象:一般有氣體放出或正極質量增加。#p#副標題#e#
(5)原電池正負極的判斷方法:
①依據原電池兩極的材料:
較活潑的金屬作負極(K、Ca、Na太活潑,不能作電極);
較不活潑金屬或可導電非金屬(石墨)、氧化物(MnO2)等作正極。
②根據電流方向或電子流向:(外電路)的電流由正極流向負極;電子則由負極經外電路流向原電池的正極。
③根據內電路離子的遷移方向:陽離子流向原電池正極,陰離子流向原電池負極。
④根據原電池中的反應類型:
負極:失電子,發生氧化反應,現象通常是電極本身消耗,質量減小。
正極:得電子,發生還原反應,現象是常伴隨金屬的析出或H2的放出。
(6)原電池電極反應的書寫方法:
(i)原電池反應所依托的化學反應原理是氧化還原反應,負極反應是氧化反應,正極反應是還原反應。因此書寫電極反應的方法歸納如下:
①寫出總反應方程式。 ②把總反應根據電子得失情況,分成氧化反應、還原反應。
③氧化反應在負極發生,還原反應在正極發生,反應物和生成物對號入座,注意酸堿介質和水等參與反應。
(ii)原電池的總反應式一般把正極和負極反應式相加而得。
(7)原電池的應用:①加快化學反應速率,如粗鋅制氫氣速率比純鋅制氫氣快。②比較金屬活動性強弱。③設計原電池。④金屬的腐蝕。
2、化學電源基本類型:
①干電池:活潑金屬作負極,被腐蝕或消耗。如:Cu-Zn原電池、鋅錳電池。
②充電電池:兩極都參加反應的原電池,可充電循環使用。如鉛蓄電池、鋰電池和銀鋅電池等。
③燃料電池:兩電極材料均為惰性電極,電極本身不發生反應,而是由引入到兩極上的物質發生反應,如H2、CH4燃料電池,其電解質溶液常為堿性試劑(KOH等)。
第三節 化學反應的速率和限度
1、化學反應的速率
(1)概念:化學反應速率通常用單位時間內反應物濃度的減少量或生成物濃度的增加量(均取正值)來表示。 計算公式:v(B)= =
①單位:mol/(L·s)或mol/(L·min)
②B為溶液或氣體,若B為固體或純液體不計算速率。
③以上所表示的是平均速率,而不是瞬時速率。
④重要規律:(i)速率比=方程式系數比 (ii)變化量比=方程式系數比
(2)影響化學反應速率的因素:
內因:由參加反應的物質的結構和性質決定的(主要因素)。
外因:①溫度:升高溫度,增大速率
②催化劑:一般加快反應速率(正催化劑)
③濃度:增加C反應物的濃度,增大速率(溶液或氣體才有濃度可言)
④壓強:增大壓強,增大速率(適用于有氣體參加的反應)
⑤其它因素:如光(射線)、固體的表面積(顆粒大小)、反應物的狀態(溶劑)、原電池等也會改變化學反應速率。
2、化學反應的限度——化學平衡
(1)在條件下,當一個可逆反應進行到正向反應速率與逆向反應速率相等時,反應物和生成物的濃度不再改變,達到表面上靜止的一種“平衡狀態”,這就是這個反應所能達到的限度,即化學平衡狀態。
化學平衡的移動受到溫度、反應物濃度、壓強等因素的影響。催化劑只改變化學反應速率,對化學平衡無影響。
在相同的條件下同時向正、逆兩個反應方向進行的反應叫做可逆反應。通常把由反應物向生成物進行的反應叫做正反應。而由生成物向反應物進行的反應叫做逆反應。
在可逆反應中,正方應進行的同時,逆反應也在進行。可逆反應不能進行到底,即是說可逆反應無論進行到何種程度,物質(反應物和生成物)的物質的量都不可能為0。
(2)化學平衡狀態的特征:逆、動、等、定、變。
①逆:化學平衡研究的對象是可逆反應。
②動:動態平衡,達到平衡狀態時,正逆反應仍在不斷進行。
③等:達到平衡狀態時,正方應速率和逆反應速率相等,但不等于0。即v正=v逆≠0。
④定:達到平衡狀態時,各組分的濃度保持不變,各組成成分的含量保持。
⑤變:當條件變化時,原平衡被破壞,在新的條件下會重新建立新的平衡。
(3)判斷化學平衡狀態的標志:
① VA(正方向)=VA(逆方向)或nA(消耗)=nA(生成)(不同方向同一物質比較)
②各組分濃度保持不變或百分含量不變
③借助顏色不變判斷(有一種物質是有顏色的)
④總物質的量或總體積或總壓強或平均相對分子質量不變(前提:反應前后氣體的總物質的量不相等的反應適用,即如對于反應xA+yB zC,x+y≠z )
- 熱門課程
- 熱門資訊
- 熱門資料
- 熱門福利
-
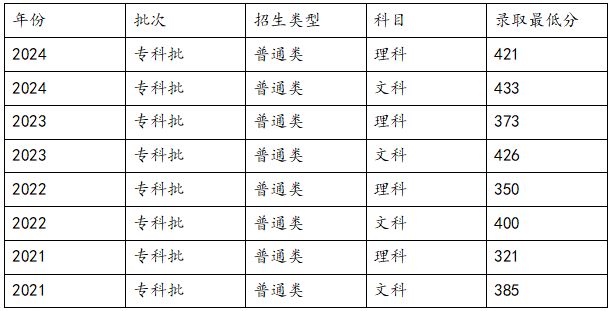 高考301分想沖刺陜工院?歷年錄取分數多少?【摘要】高考成績出來了,考了301分,孩子心里想著陜西工業職業技術學院,又緊張又期待,陜工院是國家“雙高計劃”A檔建設院校,實力很強,好多考生都想去。這時候,陜工院歷年的錄取分數就很關鍵了,能知道自己有沒有希望考上,一定要來了解一下歷年的錄取分數線。
高考301分想沖刺陜工院?歷年錄取分數多少?【摘要】高考成績出來了,考了301分,孩子心里想著陜西工業職業技術學院,又緊張又期待,陜工院是國家“雙高計劃”A檔建設院校,實力很強,好多考生都想去。這時候,陜工院歷年的錄取分數就很關鍵了,能知道自己有沒有希望考上,一定要來了解一下歷年的錄取分數線。 -
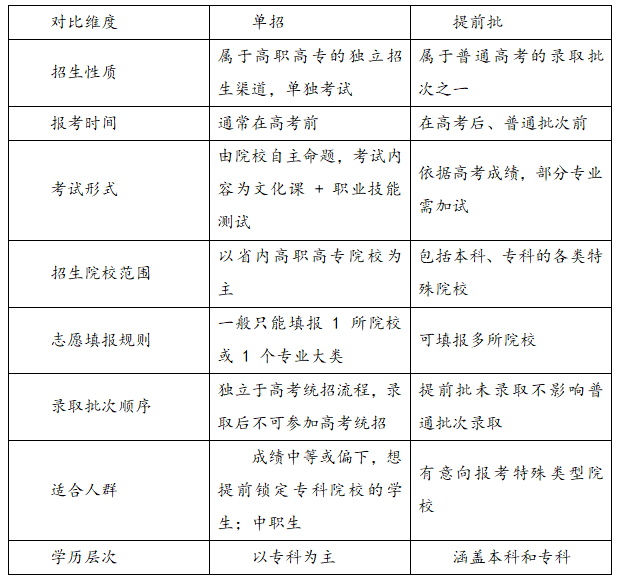 單招和提前批是什么意思?有哪些區別?一、單招和提前批是啥意思? 單招就是單獨招生,全名叫“普通高等職業教育單獨考試招生”。就是高等職業院校自己出題、自己組織考試、自己決定錄取誰,主要招中等職業學校的學生和普通高中畢業生。考試一般考文化課和職業技能。考上以后,和高考統招的學生待遇一樣。 提前批是普通高考招生里的一個錄取批次,在普
單招和提前批是什么意思?有哪些區別?一、單招和提前批是啥意思? 單招就是單獨招生,全名叫“普通高等職業教育單獨考試招生”。就是高等職業院校自己出題、自己組織考試、自己決定錄取誰,主要招中等職業學校的學生和普通高中畢業生。考試一般考文化課和職業技能。考上以后,和高考統招的學生待遇一樣。 提前批是普通高考招生里的一個錄取批次,在普 -
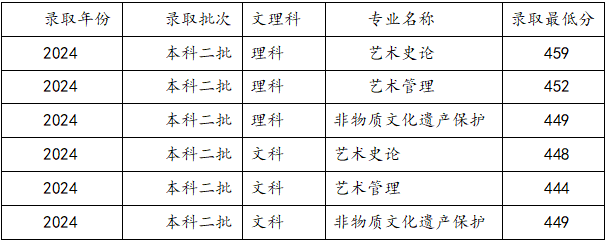 藝考音樂類包括什么專業及就業方向?西安音樂學院錄取分數【摘要】好多懷揣藝術夢想的學生都想走音樂藝考這條路,但是選啥專業對以后發展影響挺大的,考學校的話,錄取分數可是個關鍵門檻。今天咱就嘮嘮藝考音樂類有啥專業,能干啥工作,還有西安音樂學院的錄取分數是多少,讓大家心里有數,在學音樂的路上走得穩當點。
藝考音樂類包括什么專業及就業方向?西安音樂學院錄取分數【摘要】好多懷揣藝術夢想的學生都想走音樂藝考這條路,但是選啥專業對以后發展影響挺大的,考學校的話,錄取分數可是個關鍵門檻。今天咱就嘮嘮藝考音樂類有啥專業,能干啥工作,還有西安音樂學院的錄取分數是多少,讓大家心里有數,在學音樂的路上走得穩當點。 -
 單招寄宿制學校靠譜嗎?西安博大教育環境咋樣?【摘要】現在升學競爭越來越激烈,好多學生想通過單招實現上學的夢想,單招寄宿制學校就受到許多家長的關注了。那些特別想讓孩子通過單招上理想學校的家長和學生,最關心的就是這種學校靠不靠譜,能不能幫孩子實現夢想,在西安的教育機構里,西安博大教育挺受關注的,大家都想知道它的環境怎么樣。本期就跟隨小編一起看看吧!
單招寄宿制學校靠譜嗎?西安博大教育環境咋樣?【摘要】現在升學競爭越來越激烈,好多學生想通過單招實現上學的夢想,單招寄宿制學校就受到許多家長的關注了。那些特別想讓孩子通過單招上理想學校的家長和學生,最關心的就是這種學校靠不靠譜,能不能幫孩子實現夢想,在西安的教育機構里,西安博大教育挺受關注的,大家都想知道它的環境怎么樣。本期就跟隨小編一起看看吧!
-
 高考作文素材積累:流浪詩人——我的人生之路各位學生注意了,現在就要進入到2023年陰歷新年,各位學生過完年距離中高考又進了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據要求寫一篇不少于800字的文章。(60分) 黃大發,一位普
高考作文素材積累:流浪詩人——我的人生之路各位學生注意了,現在就要進入到2023年陰歷新年,各位學生過完年距離中高考又進了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據要求寫一篇不少于800字的文章。(60分) 黃大發,一位普 -
 2023年高考作文素材積累:“絕品即常品”各位學生大家覺得高考作文多少分才過關呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關,大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據要求寫一篇不
2023年高考作文素材積累:“絕品即常品”各位學生大家覺得高考作文多少分才過關呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關,大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據要求寫一篇不 -
 高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發現自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學生收藏起來! 開頭常用句子 1.Depending on per
高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發現自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學生收藏起來! 開頭常用句子 1.Depending on per -
 西安高三化學輔導班哪家好?化學現在在新高考的分量也比較重,很多專業都要求選擇化學這門課。與物理相比化學不算難。最近有學生問老師西安高三化學輔導班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補習機構,大家了解一下: 伊頓教育高三·化學輔導 基礎 1.激發學習動機2.培養學習興趣3.化學方程式總結歸納
西安高三化學輔導班哪家好?化學現在在新高考的分量也比較重,很多專業都要求選擇化學這門課。與物理相比化學不算難。最近有學生問老師西安高三化學輔導班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補習機構,大家了解一下: 伊頓教育高三·化學輔導 基礎 1.激發學習動機2.培養學習興趣3.化學方程式總結歸納




















 All right reserved
All right reserved
