高考化學(xué)考試知識點(diǎn)總結(jié)!高考化學(xué)收藏知識點(diǎn)!
其實(shí)在高三學(xué)習(xí)過程中每一科都很重要,高三化學(xué)復(fù)習(xí)主要目的應(yīng)該是幫助高考生對基本掌握的知識點(diǎn)進(jìn)行歸類總結(jié),從而是學(xué)生掌握的知識點(diǎn)更佳扎實(shí),更為系統(tǒng),高考才能事半功倍,小編為大家整理了高考化學(xué)考試知識點(diǎn),供大家學(xué)習(xí)。

高三化學(xué)考試知識點(diǎn)總結(jié)(一)
1.N2:合成氨,填充燈泡(與氬氣),保存糧食
2.稀有氣體—保護(hù)氣,霓虹燈,激光
3.H2探空氣球,氫氧焰,冶金,合成氨,高能無害燃料;
4.CO2滅火劑,制純堿,制尿素,人工降雨(干冰)
5.C.金剛石:制鉆頭石墨:制電極,坩堝,鉛筆芯,高溫潤滑劑,木炭制黑*;焦炭冶金;炭黑制油黑、顏料、橡膠耐磨添加劑
6.CaCO3:建筑石料,混凝土,煉鐵熔劑,制水泥,制玻璃,制石灰
7.Cl2:自來水消毒,制鹽酸,制漂白粉,制氯仿
8.HF:雕刻玻璃,提煉鈾,制氟化鈉農(nóng)藥
9.AgBr:感光材料;AgI:人工降雨;NaF:殺滅地下害蟲
10.S:制硫酸,硫化橡膠,制黑*,制農(nóng)藥石硫合劑,制硫磺軟膏治療皮膚病
11.P:白磷制高純度磷酸,紅磷制農(nóng)藥,制火柴,制煙幕彈
12.Si:制合金,制半導(dǎo)體。
13.SiO2:制光導(dǎo)纖維,石英玻璃,普通玻璃
14.Mg、Al制合金,鋁導(dǎo)線,鋁熱劑
15.MgO、Al2O3:耐火材料,Al2O3用于制金屬鋁
16.明礬:凈水劑;
17.CuSO4:制波爾多液;PCl3:制敵百蟲
18.漂白劑:氯氣、漂白粉(實(shí)質(zhì)是HClO);SO2(或H2SO3);Na2O2;H2O2;O3
19.消毒殺菌:氯氣,漂白粉(水消毒);高錳酸鉀(稀溶液皮膚消毒),酒精(皮膚,75%)碘酒;苯酚(粗品用于環(huán)境消毒,制洗劑,軟膏用于皮膚消);甲醛(福爾馬林環(huán)境消毒)
20.石膏:醫(yī)療繃帶,水泥硬化速度調(diào)節(jié)
21.皓礬:醫(yī)療收斂劑,木材防腐劑,媒染劑,制顏料;
22.BaSO4:制其它鋇鹽;醫(yī)療“鋇餐”
23.制半導(dǎo)體:硒,硅,鍺Ge,鎵Ga
24.K、Na合金,原子能反應(yīng)堆導(dǎo)熱劑;鋰制熱核材料,銣、銫制光電管
25.芒硝:醫(yī)療緩瀉劑;小蘇打,治療胃酸過多癥
26.磷酸鈣:工業(yè)制磷酸,制過磷酸鈣等磷肥;
27.水玻璃:礦物膠用于建筑粘合劑,耐火材料
28.MgCl2制金屬鎂(電解),Al2O3制金屬鋁(電解),NaCl制金屬鈉(電解)
29.果實(shí)催熟劑—乙烯,
30.氣焊、氣割有氧炔焰,氫氧焰
31.乙二醇用于內(nèi)燃機(jī)抗凍
32.甘油用于制*,溶劑,潤滑油

高三化學(xué)考試知識點(diǎn)總結(jié)(二)
一、物理性質(zhì)
1、有色氣體:F2(淡黃綠色)、Cl2(黃綠色)、Br2(g)(紅棕色)、I2(g)(紫紅色)、NO2(紅棕色)、O3(淡藍(lán)色),其余均為無色氣體。其它物質(zhì)的顏色見會考手冊的顏色表。
2、有刺激性氣味的氣體:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭雞蛋氣味的氣體:H2S。
3、熔沸點(diǎn)、狀態(tài):
①同族金屬從上到下熔沸點(diǎn)減小,同族非金屬從上到下熔沸點(diǎn)增大。
②同族非金屬元素的氫化物熔沸點(diǎn)從上到下增大,含氫鍵的NH3、H2O、HF反常。
③常溫下呈氣態(tài)的有機(jī)物:碳原子數(shù)小于等于4的烴、一氯甲烷、甲醛。
④熔沸點(diǎn)比較規(guī)律:原子晶體>離子晶體>分子晶體,金屬晶體不。
⑤原子晶體熔化只破壞共價鍵,離子晶體熔化只破壞離子鍵,分子晶體熔化只破壞分子間作用力。
⑥常溫下呈液態(tài)的單質(zhì)有Br2、Hg;呈氣態(tài)的單質(zhì)有H2、O2、O3、N2、F2、Cl2;常溫呈液態(tài)的無機(jī)化合物主要有H2O、H2O2、硫酸、*。
⑦同類有機(jī)物一般碳原子數(shù)越大,熔沸點(diǎn)越高,支鏈越多,熔沸點(diǎn)越低。
同分異構(gòu)體之間:正>異>新,鄰>間>對。
⑧比較熔沸點(diǎn)注意常溫下狀態(tài),固態(tài)>液態(tài)>氣態(tài)。如:白磷>二硫化碳>干冰。
⑨易升華的物質(zhì):碘的單質(zhì)、干冰,還有紅磷也能升華(隔絕空氣情況下),但冷卻后變成白磷,氯化鋁也可;三氯化鐵在100度左右即可升華。
⑩易液化的氣體:NH3、Cl2,NH3可用作致冷劑。
4、溶解性
①常見氣體溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。極易溶于水在空氣中易形成白霧的氣體,能做噴泉實(shí)驗(yàn)的氣體:NH3、HF、HCl、HBr、HI;能溶于水的氣體:CO2、SO2、Cl2、Br2(g)、H2S、NO2。極易溶于水的氣體尾氣吸收時要用防倒吸裝置。
②溶于水的有機(jī)物:低級醇、醛、酸、葡萄糖、果糖、蔗糖、淀粉、氨基酸。苯酚微溶。
③鹵素單質(zhì)在有機(jī)溶劑中比水中溶解度大。
④硫與白磷皆易溶于二硫化碳。
⑤苯酚微溶于水(大于65℃易溶),易溶于酒精等有機(jī)溶劑。
⑥硫酸鹽三種不溶(鈣銀鋇),氯化物一種不溶(銀),碳酸鹽只溶鉀鈉銨。
⑦固體溶解度大多數(shù)隨溫度升高而增大,少數(shù)受溫度影響不大(如NaCl),極少數(shù)隨溫度升高而變小[如。氣體溶解度隨溫度升高而變小,隨壓強(qiáng)增大而變大。
5、密度
①同族元素單質(zhì)一般密度從上到下增大。
②氣體密度大小由相對分子質(zhì)量大小決定。
③含C、H、O的有機(jī)物一般密度小于水(苯酚大于水),含溴、碘、硝基、多個氯的有機(jī)物密度大于水。
④鈉的密度小于水,大于酒精、苯。
6、一般,具有金屬光澤并能導(dǎo)電的單質(zhì)都是金屬?不:石墨有此性質(zhì),但它卻是非金屬?
二、結(jié)構(gòu)
1、半徑
①周期表中原子半徑從左下方到右上方減小(稀有氣體除外)。
②離子半徑從上到下增大,同周期從左到右金屬離子及非金屬離子均減小,但非金屬離子半徑大于金屬離子半徑。
③電子層結(jié)構(gòu)相同的離子,質(zhì)子數(shù)越大,半徑越小。
2、化合價
①一般金屬元素?zé)o負(fù)價,但存在金屬形成的陰離子。
②非金屬元素除O、F外均有正價。且正價與較低負(fù)價值之和為8。
③變價金屬一般是鐵,變價非金屬一般是C、Cl、S、N、O。
④任一物質(zhì)各元素化合價代數(shù)和為零。能根據(jù)化合價正確書寫化學(xué)式(分子式),并能根據(jù)化學(xué)式判斷化合價。
3、分子結(jié)構(gòu)表示方法
①是否是8電子穩(wěn)定結(jié)構(gòu),主要看非金屬元素形成的共價鍵數(shù)目對不對。鹵素單鍵、氧族雙鍵、氮族叁鍵、碳族四鍵。一般硼以前的元素不能形成8電子穩(wěn)定結(jié)構(gòu)。
②掌握以下分子的空間結(jié)構(gòu):CO2、H2O、NH3、CH4、C2H4、C2H2、C6H6、P4。
4、鍵的極性與分子的極性
①掌握化學(xué)鍵、離子鍵、共價鍵、極性共價鍵、非極性共價鍵、分子間作用力、氫鍵的概念。
②掌握四種晶體與化學(xué)鍵、范德華力的關(guān)系。
③掌握分子極性與共價鍵的極性關(guān)系。
④兩個不同原子組成的分子是極性分子。
⑤常見的非極性分子:CO2、SO3、PCl3、CH4、CCl4、C2H4、C2H2、C6H6及大多數(shù)非金屬單質(zhì)。
三、基本概念
1.區(qū)分元素、同位素、原子、分子、離子、原子團(tuán)、取代基的概念。正確書寫常見元素的名稱、符號、離子符號,包括IA、IVA、VA、VIA、VIIA族、稀有氣體元素、1~20號元素及Zn、Fe、Cu、Hg、Ag、Pt、Au等。
2.物理變化中分子不變,化學(xué)變化中原子不變,分子要改變。常見的物理變化:蒸餾、分餾、焰色反應(yīng)、膠體的性質(zhì)(丁達(dá)爾現(xiàn)象、電泳、膠體的凝聚、滲析、布朗運(yùn)動)、吸附、蛋白質(zhì)的鹽析、蒸發(fā)、分離、萃取分液、溶解除雜(酒精溶解碘)等。
常見的化學(xué)變化:化合、分解、電解質(zhì)溶液導(dǎo)電、蛋白質(zhì)變性、干餾、電解、金屬的腐蝕、風(fēng)化、硫化、鈍化、裂化、裂解、顯色反應(yīng)、同素異形體相互轉(zhuǎn)化、堿去油污、明礬凈水、結(jié)晶水合物失水、濃硫酸脫水等。(注:濃硫酸使膽礬失水是化學(xué)變化,干燥氣體為物理變化)
3.理解原子量(相對原子量)、分子量(相對分子量)、摩爾質(zhì)量、質(zhì)量數(shù)的涵義及關(guān)系。
4.純凈物有固定熔沸點(diǎn),冰水混和、H2與D2混和、水與重水混和、結(jié)晶水合物為純凈物。
混合物沒有固定熔沸點(diǎn),如玻璃、石油、鋁熱劑、溶液、懸濁液、乳濁液、膠體、子化合物、漂白粉、漂粉精、天然油脂、堿石灰、王水、同素異形體組成的物質(zhì)(O2與O3)、同分異構(gòu)體組成的物質(zhì)C5H12等。
5.掌握化學(xué)反應(yīng)分類的特征及常見反應(yīng):
a.從物質(zhì)的組成形式:化合反應(yīng)、分解反應(yīng)、置換反應(yīng)、復(fù)分解反應(yīng)。
b.從有無電子轉(zhuǎn)移:氧化還原反應(yīng)或非氧化還原反應(yīng)c.從反應(yīng)的微粒:離子反應(yīng)或分子反應(yīng)
d.從反應(yīng)進(jìn)行程度和方向:可逆反應(yīng)或不可逆反應(yīng)e.從反應(yīng)的熱效應(yīng):吸熱反應(yīng)或放熱反應(yīng)
6.同素異形體是單質(zhì),同素異形體之間的物理性質(zhì)不同、化學(xué)性質(zhì)基本相同。紅磷和白磷、O2和O3、金剛石和石墨及C60等為同素異形體,H2和D2不是同素異形體,H2O和D2O也不是同素異形體。同素異形體相互轉(zhuǎn)化為化學(xué)變化,但不屬于氧化還原反應(yīng)。
7.同位素是同種元素,不同種原子,同位素之間物理性質(zhì)不同、化學(xué)性質(zhì)基本相同。
8.同系物、同分異構(gòu)是指由分子構(gòu)成的化合物之間的關(guān)系。
9.強(qiáng)氧化性酸(濃H2SO4、濃HNO3、稀HNO3、HClO)、還原性酸(H2S、H2SO3)、*氧化物(Al2O3)、*氫氧化物[Al(OH)3]、過氧化物(Na2O2)、酸式鹽(NaHCO3、NaHSO4)
10.酸的強(qiáng)弱關(guān)系:(強(qiáng))HClO4、HCl(HBr、HI)、H2SO4、HNO3>(中強(qiáng)):H2SO3、H3PO4>(弱):CH3COOH>H2CO3>H2S>HClO>C6H5OH>H2SiO3
11.與水反應(yīng)可生成酸的氧化物不是酸性氧化物,只生成酸的氧化物"才能定義為酸性氧化物
12.既能與酸反應(yīng)又能與堿反應(yīng)的物質(zhì)是*氧化物或*氫氧化物,如SiO2能同時與HF/NaOH反應(yīng),但它是酸性氧化物
13.甲酸根離子應(yīng)為HCOO-而不是COOH-
14.離子晶體都是離子化合物,分子晶體不都是共價化合物,分子晶體許多是單質(zhì)
15.同溫同壓,同質(zhì)量的兩種氣體體積之比等于兩種氣體密度的反比
16.納米材料中細(xì)粉末粒子的直徑與膠體微粒的直徑在同一數(shù)量級,均為10-100nm
17.油脂、淀粉、蛋白質(zhì)、*、苯酚鈉、明礬、Al2S3、Mg3N2、CaC2等條件下皆能發(fā)生水解反應(yīng)
18.過氧化鈉中存在Na與O-為2:1;石英中只存在Si、O原子,不存在分子。
19.溶液的pH值越小,則其中所含的氫離子濃度就越大,數(shù)目不越多。
20.單質(zhì)如Cu、Cl2既不是電解質(zhì)也不是非電解質(zhì)
21.氯化鈉晶體中,每個鈉離子周圍距離較近且相等的氯離子有6個
22.失電子多的金屬元素,不比失電子少的金屬元素活潑性強(qiáng),如Na和Al。
23.在室溫(20C)時溶解度在10克以上——易溶;大于1克的——可溶;小于1克的——微溶;小于0.01克的——難溶。
24.膠體的帶電:一般說來,金屬氫氧化物、金屬氧化物的膠體粒子帶正電,非金屬氧化物、金屬硫化物的膠體粒子帶負(fù)電。
25.氧化性:MnO4->Cl2>Br2>Fe3>I2>S
26.能形成氫鍵的物質(zhì):H2O、NH3、HF、CH3CH2OH。
27.雨水的PH值小于5.6時就成為了酸雨。
28.取代反應(yīng)包括:鹵代、硝化、鹵代烴水解、酯的水解、酯化反應(yīng)等
29.膠體的聚沉方法:(1)加入電解質(zhì);(2)加入電性相反的膠體;(3)加熱。
30.常見的膠體:液溶膠:Fe(OH)3、AgI、牛奶、豆?jié){、粥等;氣溶膠:霧、云、煙等;固溶膠:有色玻璃、煙水晶等。
31.氨水的密度小于1,硫酸的密度大于1,98%的濃硫酸的密度為:1.84g/cm3,濃度為18.4mol/L。
32.碳水化合物不是糖類,如甲醛。
伊頓教育老師給大家整理的化學(xué)知識點(diǎn)僅僅只是知識點(diǎn),具體怎么運(yùn)用還需要大家在平時學(xué)習(xí)過程中靈活運(yùn)用,當(dāng)然如果大家有想要對高考化學(xué)課進(jìn)行補(bǔ)習(xí)的話可以在線咨詢伊頓教育哦!

- 學(xué)業(yè)水平系統(tǒng)測評
- 個性化針對教學(xué)計劃
- 線下逆襲試聽課
- 系列學(xué)科學(xué)習(xí)資料




- 熱門課程
- 熱門資訊
- 熱門資料
- 熱門福利
-
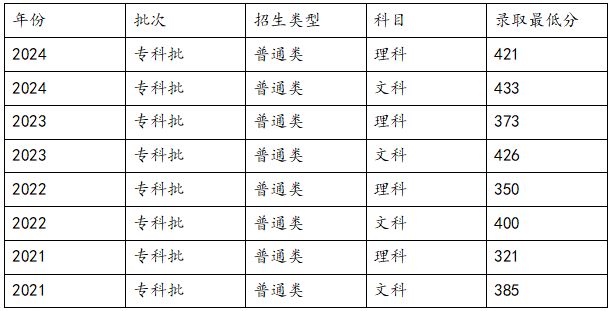 高考301分想沖刺陜工院?歷年錄取分?jǐn)?shù)多少?【摘要】高考成績出來了,考了301分,孩子心里想著陜西工業(yè)職業(yè)技術(shù)學(xué)院,又緊張又期待,陜工院是國家“雙高計劃”A檔建設(shè)院校,實(shí)力很強(qiáng),好多考生都想去。這時候,陜工院歷年的錄取分?jǐn)?shù)就很關(guān)鍵了,能知道自己有沒有希望考上,一定要來了解一下歷年的錄取分?jǐn)?shù)線。
高考301分想沖刺陜工院?歷年錄取分?jǐn)?shù)多少?【摘要】高考成績出來了,考了301分,孩子心里想著陜西工業(yè)職業(yè)技術(shù)學(xué)院,又緊張又期待,陜工院是國家“雙高計劃”A檔建設(shè)院校,實(shí)力很強(qiáng),好多考生都想去。這時候,陜工院歷年的錄取分?jǐn)?shù)就很關(guān)鍵了,能知道自己有沒有希望考上,一定要來了解一下歷年的錄取分?jǐn)?shù)線。 -
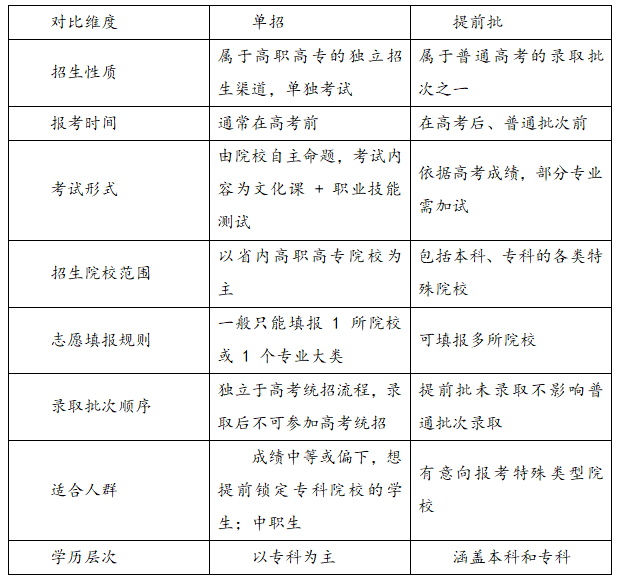 單招和提前批是什么意思?有哪些區(qū)別?一、單招和提前批是啥意思? 單招就是單獨(dú)招生,全名叫“普通高等職業(yè)教育單獨(dú)考試招生”。就是高等職業(yè)院校自己出題、自己組織考試、自己決定錄取誰,主要招中等職業(yè)學(xué)校的學(xué)生和普通高中畢業(yè)生。考試一般考文化課和職業(yè)技能。考上以后,和高考統(tǒng)招的學(xué)生待遇一樣。 提前批是普通高考招生里的一個錄取批次,在普
單招和提前批是什么意思?有哪些區(qū)別?一、單招和提前批是啥意思? 單招就是單獨(dú)招生,全名叫“普通高等職業(yè)教育單獨(dú)考試招生”。就是高等職業(yè)院校自己出題、自己組織考試、自己決定錄取誰,主要招中等職業(yè)學(xué)校的學(xué)生和普通高中畢業(yè)生。考試一般考文化課和職業(yè)技能。考上以后,和高考統(tǒng)招的學(xué)生待遇一樣。 提前批是普通高考招生里的一個錄取批次,在普 -
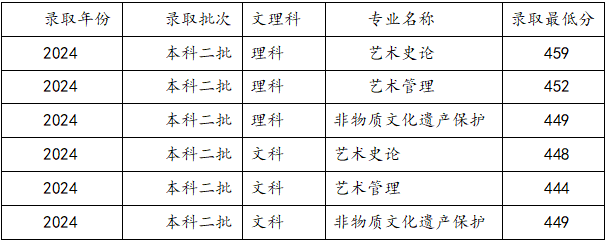 藝考音樂類包括什么專業(yè)及就業(yè)方向?西安音樂學(xué)院錄取分?jǐn)?shù)【摘要】好多懷揣藝術(shù)夢想的學(xué)生都想走音樂藝考這條路,但是選啥專業(yè)對以后發(fā)展影響挺大的,考學(xué)校的話,錄取分?jǐn)?shù)可是個關(guān)鍵門檻。今天咱就嘮嘮藝考音樂類有啥專業(yè),能干啥工作,還有西安音樂學(xué)院的錄取分?jǐn)?shù)是多少,讓大家心里有數(shù),在學(xué)音樂的路上走得穩(wěn)當(dāng)點(diǎn)。
藝考音樂類包括什么專業(yè)及就業(yè)方向?西安音樂學(xué)院錄取分?jǐn)?shù)【摘要】好多懷揣藝術(shù)夢想的學(xué)生都想走音樂藝考這條路,但是選啥專業(yè)對以后發(fā)展影響挺大的,考學(xué)校的話,錄取分?jǐn)?shù)可是個關(guān)鍵門檻。今天咱就嘮嘮藝考音樂類有啥專業(yè),能干啥工作,還有西安音樂學(xué)院的錄取分?jǐn)?shù)是多少,讓大家心里有數(shù),在學(xué)音樂的路上走得穩(wěn)當(dāng)點(diǎn)。 -
 單招寄宿制學(xué)校靠譜嗎?西安博大教育環(huán)境咋樣?【摘要】現(xiàn)在升學(xué)競爭越來越激烈,好多學(xué)生想通過單招實(shí)現(xiàn)上學(xué)的夢想,單招寄宿制學(xué)校就受到許多家長的關(guān)注了。那些特別想讓孩子通過單招上理想學(xué)校的家長和學(xué)生,最關(guān)心的就是這種學(xué)校靠不靠譜,能不能幫孩子實(shí)現(xiàn)夢想,在西安的教育機(jī)構(gòu)里,西安博大教育挺受關(guān)注的,大家都想知道它的環(huán)境怎么樣。本期就跟隨小編一起看看吧!
單招寄宿制學(xué)校靠譜嗎?西安博大教育環(huán)境咋樣?【摘要】現(xiàn)在升學(xué)競爭越來越激烈,好多學(xué)生想通過單招實(shí)現(xiàn)上學(xué)的夢想,單招寄宿制學(xué)校就受到許多家長的關(guān)注了。那些特別想讓孩子通過單招上理想學(xué)校的家長和學(xué)生,最關(guān)心的就是這種學(xué)校靠不靠譜,能不能幫孩子實(shí)現(xiàn)夢想,在西安的教育機(jī)構(gòu)里,西安博大教育挺受關(guān)注的,大家都想知道它的環(huán)境怎么樣。本期就跟隨小編一起看看吧!
-
 高考作文素材積累:流浪詩人——我的人生之路各位學(xué)生注意了,現(xiàn)在就要進(jìn)入到2023年陰歷新年,各位學(xué)生過完年距離中高考又進(jìn)了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優(yōu)秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據(jù)要求寫一篇不少于800字的文章。(60分) 黃大發(fā),一位普
高考作文素材積累:流浪詩人——我的人生之路各位學(xué)生注意了,現(xiàn)在就要進(jìn)入到2023年陰歷新年,各位學(xué)生過完年距離中高考又進(jìn)了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優(yōu)秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據(jù)要求寫一篇不少于800字的文章。(60分) 黃大發(fā),一位普 -
 2023年高考作文素材積累:“絕品即常品”各位學(xué)生大家覺得高考作文多少分才過關(guān)呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關(guān),大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據(jù)要求寫一篇不
2023年高考作文素材積累:“絕品即常品”各位學(xué)生大家覺得高考作文多少分才過關(guān)呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關(guān),大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據(jù)要求寫一篇不 -
 高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學(xué)就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發(fā)現(xiàn)自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學(xué)生收藏起來! 開頭常用句子 1.Depending on per
高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學(xué)就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發(fā)現(xiàn)自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學(xué)生收藏起來! 開頭常用句子 1.Depending on per -
 西安高三化學(xué)輔導(dǎo)班哪家好?化學(xué)現(xiàn)在在新高考的分量也比較重,很多專業(yè)都要求選擇化學(xué)這門課。與物理相比化學(xué)不算難。最近有學(xué)生問老師西安高三化學(xué)輔導(dǎo)班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補(bǔ)習(xí)機(jī)構(gòu),大家了解一下: 伊頓教育高三·化學(xué)輔導(dǎo) 基礎(chǔ) 1.激發(fā)學(xué)習(xí)動機(jī)2.培養(yǎng)學(xué)習(xí)興趣3.化學(xué)方程式總結(jié)歸納
西安高三化學(xué)輔導(dǎo)班哪家好?化學(xué)現(xiàn)在在新高考的分量也比較重,很多專業(yè)都要求選擇化學(xué)這門課。與物理相比化學(xué)不算難。最近有學(xué)生問老師西安高三化學(xué)輔導(dǎo)班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補(bǔ)習(xí)機(jī)構(gòu),大家了解一下: 伊頓教育高三·化學(xué)輔導(dǎo) 基礎(chǔ) 1.激發(fā)學(xué)習(xí)動機(jī)2.培養(yǎng)學(xué)習(xí)興趣3.化學(xué)方程式總結(jié)歸納















 All right reserved
All right reserved
