初中化學方程式配平的方法總結!漢中市中考化學一對一在哪里?
化學方程式配平是化學學習的基礎內容,很重要但卻不簡單,尤其是化學這門學科是中考才開始學習的,所以說對學生來說是有考驗的,不過伊頓教育網小編為中考學生們整理了關于化學方程式配平的方法和技巧,各位學生們可以好好學習一下!漢中市的化學一對一補習可以選擇伊頓教育補習班,漢中市的伊頓教育校區位于漢臺區蓮湖西路漢臺中學東側,想要了解詳細的補習情況和課程安排的學生家長可以撥打電話:400-029-6659

01較小公倍數法
本法也是配平化學反應方程式慣用的方法,通常用于較簡單的化學方程式的配平,或者作為配平復雜反應的輔助方主。運用此法一般可按下述步驟去進行:
1.首先,找出反應式左右兩端原子數較多的某一只出現一次的元素,求出它們的較小公倍數。
2,其次,將此較小公倍數分別除以左右兩邊原來的原子數,所得之商值,就分別是它們所在化學式的系數。
3.然后,依據已確定的物質化學式的系數、推導并求出它化學式的系數,直至將方程式配平為止。
4.較后,驗證反應式。配平是否正確。
[例1]試配平磁鐵礦(Fe3O4)與鋁粉共燃的反應方程Fe3O4十Al——Fe十Al2O3
(1)該反應氧原子數較多且在兩邊只出現一次,故先求出兩邊氧原子數的較小公倍數:4×3=12。
(2)根據質量守恒定律,要使反應式左右兩邊的氧原子數相等,Fe3O4的系數需要為3(12/4),AI2O3的系數需要為4(12/3)即:3Fe3O4十A1——Fe十4A12O3
(3)再配Fe和AL原子。由已配得的3Fe3O4和4Al2O3可知,Fe和Al的系數分別為9和8時,左右兩邊的Fe和Al的原子數才相等,故有:3Fe3O4+8Al——9Fe+4Al2O3
(4)較后檢驗,得完整的化學方程式為:3Fe3O4+8A======9Fe+4Al2O3
02奇數配偶數法
用奇數配偶數法去配平化學反應方程式的原理是:
一、兩個奇數或兩個偶數之和為偶數;奇數與偶數之和則為奇數——簡稱加法則。奇數與偶數或兩個偶數之積為偶數;兩個奇數之積則仍為奇數——簡稱乘法則。
二、依質量守恒定律,反應前后各元素的原子總數相等。其配平方法可按以下步驟進行:
1.找出化學反應式左右兩邊出現次數較多的元素,且該元素的原子個數在反應式左右兩邊有奇數也有偶數;
2.選定含該元素奇數個原子的化學式,作為配乎起點,選配適當系數,使之偶數化;
3.由已推得的系數,來確定其它物質的系數;
較后,驗證方程式是否正確。
[例1]配平FeS2十O2——Fe2O3十SO2
[分析](1)從反應方程式可知,氧元素在兩邊出現的次數較多,且其原子個數在兩邊有奇數亦有偶數。
(2)反應式左邊有O2,由“乘法則”可知,其系數無論為何,O原子總數必為偶,而由“加法則”可知,要使右邊O原子總數亦為偶,就需要給右邊含奇數個氧原子的Fe2O3系數選配2,使之偶數化,則:
FeS2十O2——2 Fe2O3十SO2
(3)由已確定的系數,推出與此有關的其它物質的系數。反應式右邊有4個Fe原子,故左邊FeS2的系數須配4,則:4FeS2十O2——2 Fe2O3十SO2
然后以左邊的S原子數,推得右邊應有8SO2,即:4FeS2十O2——2 Fe2O3十8SO2
較后配平O原子,當左邊有11O2時,反應式則可配平為:4FeS2十11O2——2 Fe2O3十8SO2
03代數法——待定系數法
代數法也叫待定系數法,其方法步驟如下:
1.設a、b、c、d等未知數,分別作為待配平的化學方程式兩端各項化學式的系數。
2.根據質量守恒定律,反應前后各元素的原子種類和個數需要相等同的原則,列出每種元素的原子數與化學式系數。
a、b、c、d……關系的代數式,這些代數式可聯立成一待定方程組:
3.解此待定方程組、就可求得各未知數之間的倍數關系。a=xb=yc=zd=...
4.令某未知數為某一正整數,使其它未知數成為較小正整數,將所得的a、b、c、d等值代入原化學反應式的待定位置,配平即告完成。
例:配平Fe2O3十CO——Fe十CO2
分析:(1)設a、b、c、d分別為反應式中各物質化學式的系數:
aFe2O3十bCO——cFe十dCO2
(2)依據質量守恒定律:反應前后各元素的原子數目需要
相等,列出a、b、c、d的關系式:
對Fe原子有:2a=c①
對O原子有:3a十b=2d②
對C原于有:b=d③
(3)解①一②的聯立方程組,可得下列關系:a=1/3 b=1/2 c=1/3 d
(4)為了使各個系數成為較小的正整數,而無公約數,令
d=3,則a=1,b=3,c=2。將a、b、c、d的值代人原化學反應式的相應位置,即得配平的方程式為:
Fe2O3十3CO====2Fe十3CO2
(5)別忘了檢驗一下,方程式確已配平了;
須注意的是,只要增加各系數為無公約數的較小正整數。令b=3或c=2,也可得到相同的配平式。
04 電子得失法
電子得失法的原理是:氧化一還原反應中,還原劑失去電子的總數需要等于氧化劑獲得電子的總數。根據這一規則,可以配平氧化一還原反應方程式。
1.從反應式里找出氧化劑和還原劑,并標明被氧化或還原元素的原子在反應前后化合價發生變化的情況,以便確定它們的電子得失數。
2。使得失電子數相等,由此確定氧化劑和還原劑等有關物質化學式的系數。
3.由已得的系數,判定其它物質的系數,由此得配平的反應式。
[例1]配平金屬銅與濃硝酸起反應的化學方程式:
Cu十HNO3(濃)——Cu(NO3)2十NO2↑十H2O
[分析](1)從反應式看,HNO3為氧化劑,Cu為還原劑。其化合價的變化和電子得失的情況為:0+5+2+4
Cu+HNO3---Cu(NO3)2+NO2+H2O
(2)使電子得失數相等,由此確定以此有關的物質的系數:0+5+2+4
1Cu十HNO3——1Cu(NO3)2十2NO2十H2O
(3)據此,推斷其它化學式的系數:反應式右邊生成物多出2個N原子,故需要在反應式左邊再增加2個HNO3才可使兩邊的N原子平衡,此時左邊共有4個HN03,為使兩邊的氫原子數相等,右邊H2O的系數應配為2,于是得:Cu十4HNO3——Cu(NO3)2十2NO2十2H2O
(4)氧原子未作考慮,但系數均已確定了,故還得較后驗證一下,若兩邊的氧原子平衡了,則方程式就可被確認配平。實際上上式的氧原于已平衡了,故得:Cu十4HNO3======Cu(NO3)2十2NO2↑十2H2O
05 歸一法
找到化學方程式中關鍵的化學式,定其化學式前計量數為1,然后根據關鍵化學式去配平其他化學式前的化學計量數。若出現計量數為分數,再將各計量數同乘以同一整數,化分數為整數,這種先定關鍵化學式計量數為1的配平方法,稱為歸一法。做法:選擇化學方程式中組成較復雜的化學式,設它的系數為1,再依次推斷。
第一步:設NH3的系數為1 1NH3+O2——NO+H2O
第二步:反應中的N原子和H原子分別轉移到NO和H2O中。
第三步:由右端氧原子總數推O2系數
1、FeS2+O2——SO2+Fe2O3 2、Mg+HNO3——Mg(NO3)2+NH4NO3+H2O
3、NH4NO3——N2+O2+H2O 4、FeS+KMnO4+H2SO4——K2SO4+MnSO4+Fe2(SO4)3+H2O+S↓
以上關于初中生化學方程式配平的方法你學會了嗎?如果化學學習有困難的話,可以隨時咨詢伊頓教育的老師,伊頓教育的課程安排和班型配置都很完善,可以滿足學生和家長的需求!
- 熱門課程
- 熱門資訊
- 熱門資料
- 熱門福利
-
 單招全日制學校是什么?伊頓單招好還是西安弘雅好?【摘要】現在職業教育發展得挺好,單招全日制學校被越來越多人知道了,不少學生把它當成升學的重要途徑。不過呢,好多人對單招全日制學校是啥還不太清楚,選輔導機構的時候也不知道咋選。特別是伊頓單招和西安弘雅,這兩家挺受關注的,到底哪個更好呢?下面咱們就來好好研究研究。
單招全日制學校是什么?伊頓單招好還是西安弘雅好?【摘要】現在職業教育發展得挺好,單招全日制學校被越來越多人知道了,不少學生把它當成升學的重要途徑。不過呢,好多人對單招全日制學校是啥還不太清楚,選輔導機構的時候也不知道咋選。特別是伊頓單招和西安弘雅,這兩家挺受關注的,到底哪個更好呢?下面咱們就來好好研究研究。 -
 三校生單招落榜適合復讀嗎?總分350分一年能提高到多少?【摘要】三校生單招沒考上,適合復讀不?要是總分 350 分,復讀一年能提多少分呢?好一些家長心里都有這些疑問,因為決定復讀之后,家長和學生的心愿肯定是希望孩子能考到一個好的大學,那么為考好大學,報名機構復讀的話一年能提高多少分呢?下面咱就好好聊聊。
三校生單招落榜適合復讀嗎?總分350分一年能提高到多少?【摘要】三校生單招沒考上,適合復讀不?要是總分 350 分,復讀一年能提多少分呢?好一些家長心里都有這些疑問,因為決定復讀之后,家長和學生的心愿肯定是希望孩子能考到一個好的大學,那么為考好大學,報名機構復讀的話一年能提高多少分呢?下面咱就好好聊聊。 -
 高三單招想復讀?西安伊頓單招好不好?【摘要】高三升學的時候,單招是好多同學提前確定能上哪個大學的辦法,不過呢,有些同學單招完了,對錄取的學校或者專業不滿意,就想復讀。要是有這想法,得先搞清楚自己能不能復讀,再找個靠譜的復讀機構,那高三單招后復讀,政策上讓不讓呢?西安伊頓在單招復讀輔導方面表現好不好呢?本期,小編就來大揭秘!
高三單招想復讀?西安伊頓單招好不好?【摘要】高三升學的時候,單招是好多同學提前確定能上哪個大學的辦法,不過呢,有些同學單招完了,對錄取的學校或者專業不滿意,就想復讀。要是有這想法,得先搞清楚自己能不能復讀,再找個靠譜的復讀機構,那高三單招后復讀,政策上讓不讓呢?西安伊頓在單招復讀輔導方面表現好不好呢?本期,小編就來大揭秘! -
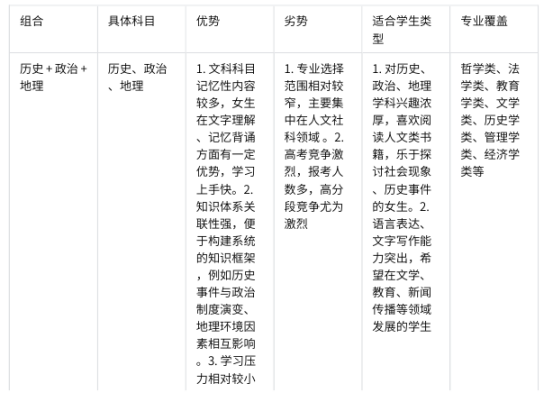 女生高一選科最好的3種組合?2025有哪些選科技巧?【摘要】2025 年選科有啥技巧不?在高中學習里,選科可太重要了,對女生來說更是這樣。選對科目組合,不光影響現在學習順不順,還會影響以后能選啥專業、能干啥工作,2025 年選科有新政策、新變化,咋選才最合適呢?下面咱就好好說說。
女生高一選科最好的3種組合?2025有哪些選科技巧?【摘要】2025 年選科有啥技巧不?在高中學習里,選科可太重要了,對女生來說更是這樣。選對科目組合,不光影響現在學習順不順,還會影響以后能選啥專業、能干啥工作,2025 年選科有新政策、新變化,咋選才最合適呢?下面咱就好好說說。
-
 高考作文素材積累:流浪詩人——我的人生之路各位學生注意了,現在就要進入到2023年陰歷新年,各位學生過完年距離中高考又進了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據要求寫一篇不少于800字的文章。(60分) 黃大發,一位普
高考作文素材積累:流浪詩人——我的人生之路各位學生注意了,現在就要進入到2023年陰歷新年,各位學生過完年距離中高考又進了一步,為方便大家能夠積累更多的作文素材,小編老師為定期為大家更新優秀范文,下面大家一起來賞析“流浪詩人——我的人生之路”。 作文題 閱讀下面的材料,根據要求寫一篇不少于800字的文章。(60分) 黃大發,一位普 -
 2023年高考作文素材積累:“絕品即常品”各位學生大家覺得高考作文多少分才過關呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關,大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據要求寫一篇不
2023年高考作文素材積累:“絕品即常品”各位學生大家覺得高考作文多少分才過關呢?小編老師覺得作文滿分60分大家作文在56分以上才算是過關,大家都知道高考一分之差差之千里,大家不要放過任何一個可以提分的可能!為幫助大家積累素材,小編老師為大家整理了比較好的作文題目和作文范文,供大家參考! 作文題 閱讀下面的材料,根據要求寫一篇不 -
 高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發現自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學生收藏起來! 開頭常用句子 1.Depending on per
高考英語素材,高考英語作文開頭常用句子高考英語素材,高考英語作文開頭常用句子!一提到英文寫作,很多同學就頭疼,如何組織語言、如何下筆呢?但自從知道了一些萬能的“套話”你就會發現自己的寫作水平會更上一層樓!下面小編老師為大家整理了高考英語作文開頭常用句子,想要了解的學生收藏起來! 開頭常用句子 1.Depending on per -
 西安高三化學輔導班哪家好?化學現在在新高考的分量也比較重,很多專業都要求選擇化學這門課。與物理相比化學不算難。最近有學生問老師西安高三化學輔導班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補習機構,大家了解一下: 伊頓教育高三·化學輔導 基礎 1.激發學習動機2.培養學習興趣3.化學方程式總結歸納
西安高三化學輔導班哪家好?化學現在在新高考的分量也比較重,很多專業都要求選擇化學這門課。與物理相比化學不算難。最近有學生問老師西安高三化學輔導班哪家好?下面,小編老師為大家推薦西安一家比較好的高中補習機構,大家了解一下: 伊頓教育高三·化學輔導 基礎 1.激發學習動機2.培養學習興趣3.化學方程式總結歸納




















 All right reserved
All right reserved
